Carbonsäuren: Unterschied zwischen den Versionen
Dg (Diskussion | Beiträge) |
Dg (Diskussion | Beiträge) |
||
| Zeile 86: | Zeile 86: | ||
{{cb|-|266 u. 418|113}} | {{cb|-|266 u. 418|113}} | ||
{{www}} | {{www}} | ||
| − | + | {{cona|Chemie_Carbonsaeure.pdf}} | |
{{Chemikalien}} | {{Chemikalien}} | ||
[[Kategorie:Chemie]][[Kategorie:Chemikalien]] | [[Kategorie:Chemie]][[Kategorie:Chemikalien]] | ||
[[Kategorie:Ernährungslehre]] | [[Kategorie:Ernährungslehre]] | ||
Version vom 17. August 2015, 19:01 Uhr
| Carbonsäuren | ||
|---|---|---|
| vernetzte Artikel | ||
| Säure-Base-Reaktionen | Carboxylgruppe | |
Inhaltsverzeichnis
Was sind Carbonsäuren?
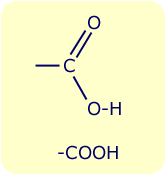
Carbonsäuren sind organische Säuren bestehend aus einer Kohlenwasserstoffkette mit der funktionellen Gruppe -COOH (Carboxylgruppe). Sie kommen sowohl als freie Säure als auch in veresterter Form in der Natur vor (z. B. Schweiß, Tiersekrete, Pflanzensäfte).
Einteilung
Carbonsäuren sind unterteilt in:
- gesättigte Carbonsäuren: Alkansäuren, also nur Einfachbindungen im Rest
- ungesättigte Carbonsäuren (Alkensäuren) mit mindestens einer Doppelbindung im Rest
- Fettsäuren sind langkettige Carbonsäuren (mehr als 4 C-Atomen) und können gesättigt oder ungesättigt sein
- nach Anzahl der Carboxylgruppen unterscheidet man in Monocarbonsäuren , Di-C. usw.
Verwendung
Die Verwendung der Carbonsäuren und ihrer Salze ist äußerst vielseitig. Sie dienen als Lebensmittel-Zusatzstoffe und stellen wichtige Zwischenprodukte für zahlreiche andere Stoffe und Stoffgruppen der organischen Chemie dar, z.B. zur Herstellung von Riechstoffen oder von Kunststoffen, Seifen, Tensiden, Harzen, Medikamenten und Farbstoffen.
Eigenschaften
- farblos
- stark riechend
- flüssig oder fest
- polar (bei kurzer C-Kette polar bei langer unpolar)
- hoher Siedepunkt (mit zunehmender Kettenlänge steigen die Van-der-Waals-Kräfte -> hoher Siedepunkt)
- hoher Schmelzpunkt
- leiten Strom (nur wenn sie mit Wasser verdünnt sind und Ionen bilden)
- brennbar
- reagieren mit Laugen zu Wasser + Salz
- reagieren mit Alkohol zu Wasser + Ester
Acidität
- Carbonsäuren reagieren in wässrigen Lösungen sauer. Die korrespondierende Base ist das Carboxylat-Anion (COO-)
- Dies ist auf den negativen induktiven Effekt des Carbonyl-O-Atoms zurückzuführen (Carbonylgruppe >C=O) Die Elektronen werden dem H-Atom entzogen Richtung O-Atom, dadurch kann es als H+ leichter abgespalten werden.
- Die Acidität nimmt mit zunehmender Länge des Alkylrests ab. Der nun zunehmende positive induktive Effekt des Alkylrests (R) vermindert die Polarität der OH-Bindung. Das H kann nicht so leicht abgespalten werden.
- Allerdings können Substituenten im Alkylrest (Atome bzw Atomgruppen) auch die Acidität erhöhen (je nach Stärke des positiven induktiven Effekt).
 Quelle: http://www.oci.uzh.ch
Quelle: http://www.oci.uzh.ch
Auswahl bedeutsamer Carbonsäuren
Ameisensäure
Ascorbinsäure
Buttersäure
Citronensäure
Essigsäure
Milchsäure
Oxalsäure
Propionsäure
Sorbinsäure
Experimente
- Acidität von Carbonsäuren - Reaktion mit Magnesium, in: Chemie? - Aber sicher!, Seite 15-11
- Acidität von Carbonsäuren - pH-Wert-Messung, in: Chemie? - Aber sicher!, Seite 15-12
- Redoxreaktionen von Carbonyl-Verbindungen: Ameisensäure und Essigsäure im Vergleich, in: Chemie heute SII, Seite 322, Versuch 2
- Redoxreaktionen von Carbonyl-Verbindungen: Synthese von Essigsäure, in: Chemie heute SII, Seite 322, Versuch 3
Carbonsäuren in Lebensmitteln
- Bestimmung des Säuregrades von Milch
- Bestimmung der Säure-Konzentration in Nahrungsmitteln, in: Chemie heute (Ausgabe 1998), Seite 123, Versuch 5
- Bestimmung des pKS-Wertes von Sorbinsäure, in: Chemie heute (Ausgabe 1998), Seite 276, Versuch 2
- Organische Säuren in Lebensmitteln, in: Elemente Chemie 2, Seite 116, Versuch 1-3
- Säuren und Basen in Produkten des Alltags, in: Elemente Chemie 2, Seite 222, Versuch 1-4
Aromastoffe aus Carbonsäuren
- Aromastoffe, in: Chemie heute (Ausgabe 1998), Seite 274, Versuch 1
Herstellung von Brausepulver
Material:
- 1 Becherglas
- Teelöffel
Chemikalien bzw. Lebensmittel:
- Natronpulver (Natriumhydrogencarbonat)3 Löffelenden
- Citronensäure 1 kleinen Teelöffel
- Götterspeise für den Geschmack 1 großen Teelöffel
- Zucker 1 Teelöffel
Durchführung:
Alle Zutaten in das Becherglas geben und gut verrühren.
Folgende Reaktion findet statt:
NaHCO3 + C6H8O7 ![]() COONa + H2O + CO2 + C5H7O5
COONa + H2O + CO2 + C5H7O5
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Carbonsäuren: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |
Weblinks
- Carbonsäuren als Google-Suchbegriff
- Carbonsäuren in der Wikipedia
- Carbonsäuren hier in bs-wiki.de mit Google
- Carbonsäuren als Youtube-Video
- Versuchsanleitungen der Fa. Conatex zum Thema Carbonsäuren als PDF-Datei zum Download
| |
Auf Chemikalien-Gefäßen finden sich codierte Hinweise auf Gefährdungen und entsprechende Vorsorgemaßnahmen beim Umgang mit dieser Chemikalie. Diese sogenannten H- & P-Sätze hängen gemeinsam mit den Arbeitsregeln für Schülerexperimente als Betriebsanweisung im Chemieraum aus und müssen in jedem Fall beachtet werden! |