Radioaktivität: Unterschied zwischen den Versionen
Kati (Diskussion | Beiträge) |
Kati (Diskussion | Beiträge) |
||
| Zeile 37: | Zeile 37: | ||
Entdeckt wurden solche unsichtbaren, energiereichen Strahlungen von Henri Becquerel 1896. Er untersuchte Uranverbindungen auf einen Zusammenhang zwischen Fluoreszenz und Röntgenstrahlung. Dabei entdeckte er, dass Uran eine unsichtbare energiereiche Strahlung aussendet. | Entdeckt wurden solche unsichtbaren, energiereichen Strahlungen von Henri Becquerel 1896. Er untersuchte Uranverbindungen auf einen Zusammenhang zwischen Fluoreszenz und Röntgenstrahlung. Dabei entdeckte er, dass Uran eine unsichtbare energiereiche Strahlung aussendet. | ||
In der Folgezeit untersuchten Marie und Pierre Curie ein stärker strahlendes Uranerz, die Uranpechblende. Sie isolierten im Jahr 1898 daraus die Elemente Polonium und Radium. Sie stellten auch zum ersten Mal klar, dass Radioaktivität kein chemischer Vorgang ist, sondern dass hierbei der Atomkern seinen Charakter ändert. Von Marie Curie stammt auch die Bezeichnung „Radioaktivität“ für energiereiche Strahlung aus Atomen (lat. Radius: der Strahl). | In der Folgezeit untersuchten Marie und Pierre Curie ein stärker strahlendes Uranerz, die Uranpechblende. Sie isolierten im Jahr 1898 daraus die Elemente Polonium und Radium. Sie stellten auch zum ersten Mal klar, dass Radioaktivität kein chemischer Vorgang ist, sondern dass hierbei der Atomkern seinen Charakter ändert. Von Marie Curie stammt auch die Bezeichnung „Radioaktivität“ für energiereiche Strahlung aus Atomen (lat. Radius: der Strahl). | ||
| + | Der Energieumsatz beim radioaktiven Zerfall ist um vieles größer als bei chemischen Reaktionen. Die Energie der radioaktiven Strahlung wird häufig in Elektronenvolt (eV) | ||
| + | Angegeben: 1 eV ist diejenige kinetische Energie, die ein Teilchen mit der Ladung eines Elektrons (1e) im Vakuum aufnimmt, wenn es eine Spannung von 1 Volt durchläuft. | ||
| + | |||
| + | Halbwertszeit: | ||
| + | |||
| + | Die Halbwertszeit ist die Zeit, nach der die Hälfte der Atome in einer Probe zerfallen ist. Die Halbwertszeit ist für ein gegebenes Isotop immer gleich; sie hängt nicht davon ab, wie viele Atome wir noch haben oder wie lange sie schon gelebt haben. | ||
| + | Die Halbwertszeiten von Nukliden sind unterschiedlich und reichen von Bruchteilen von Sekunden bis zu mehreren Milliarden Jahren. | ||
| + | |||
| + | Radionuklid Halbwertszeit | ||
| + | Polonium-214 160 Mikrosekunden | ||
| + | Wismut-214 19,9 Minuten | ||
| + | Radon-222 3,8 Tage | ||
| + | Blei-210 22 Jahre | ||
| + | Radium-226 1600 Jahre | ||
| + | Kohlenstoff-14 5370 Jahre | ||
| + | Uran-235 700 Millionen Jahre | ||
| + | Kalium-40 1,3 Milliarden Jahre | ||
| + | Uran-238 4,5 Milliarden Jahre | ||
| + | |||
Version vom 14. Januar 2008, 09:08 Uhr
| Radioaktivität | ||
|---|---|---|
| vernetzte Artikel | ||
| Kernenergie | Isotope | |
Unter Radioaktivität versteht man den natürlichen Zerfall instabiler Isotope in für diese charakteristischen Zeiten, den sogenannten Halbwertzeiten. Die Art der emittierten Strahlung bestimmt bei diesem Zerfallsvorgang die Folgeprodukte:
Inhaltsverzeichnis
Strahlungsarten

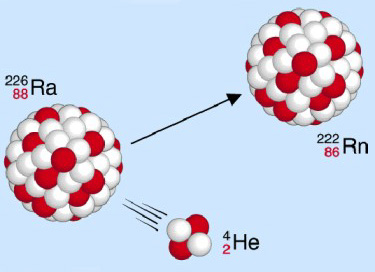
Alpha-Strahlung
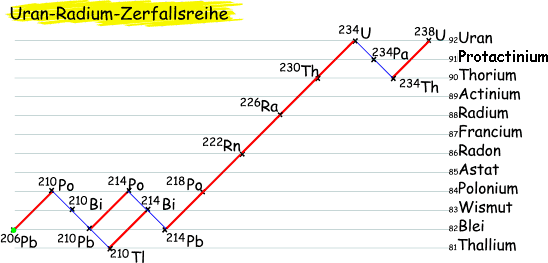
Ein Alpha-Strahler emittiert Heliumkerne (Alphateilchen), somit vermindert sich für das Folgeprodukt die Massenzahl um den Wert vier, die Ordnungszahl um zwei.
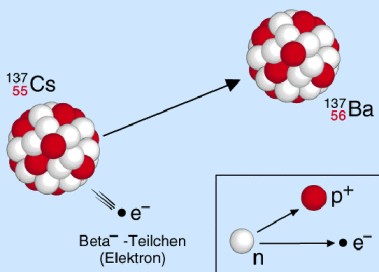
Beta-Strahlung
Beta-Strahlung hingegen besteht aus Elektronen, die durch Spaltung eines instabilen Neutrons entstehen. Damit kann für das Isotop des Folgeproduktes sowohl die Massen- als auch die Ordnungszahl errechnet werden.
Hierbei gilt: die Massenzahl bleibt konstant, die Ordnungszahl erhöht sich um den Wert eins.
So zerfällt der radioaktive Beta-Strahler Kohlenstoff C-14 in das stabile Isotop N-14 des Elementes Stickstoff.
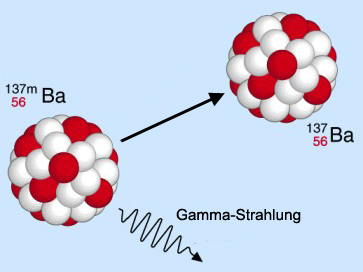
Gamma-Strahlung
Entdeckt wurden solche unsichtbaren, energiereichen Strahlungen von Henri Becquerel 1896. Er untersuchte Uranverbindungen auf einen Zusammenhang zwischen Fluoreszenz und Röntgenstrahlung. Dabei entdeckte er, dass Uran eine unsichtbare energiereiche Strahlung aussendet. In der Folgezeit untersuchten Marie und Pierre Curie ein stärker strahlendes Uranerz, die Uranpechblende. Sie isolierten im Jahr 1898 daraus die Elemente Polonium und Radium. Sie stellten auch zum ersten Mal klar, dass Radioaktivität kein chemischer Vorgang ist, sondern dass hierbei der Atomkern seinen Charakter ändert. Von Marie Curie stammt auch die Bezeichnung „Radioaktivität“ für energiereiche Strahlung aus Atomen (lat. Radius: der Strahl). Der Energieumsatz beim radioaktiven Zerfall ist um vieles größer als bei chemischen Reaktionen. Die Energie der radioaktiven Strahlung wird häufig in Elektronenvolt (eV) Angegeben: 1 eV ist diejenige kinetische Energie, die ein Teilchen mit der Ladung eines Elektrons (1e) im Vakuum aufnimmt, wenn es eine Spannung von 1 Volt durchläuft.
Halbwertszeit:
Die Halbwertszeit ist die Zeit, nach der die Hälfte der Atome in einer Probe zerfallen ist. Die Halbwertszeit ist für ein gegebenes Isotop immer gleich; sie hängt nicht davon ab, wie viele Atome wir noch haben oder wie lange sie schon gelebt haben.
Die Halbwertszeiten von Nukliden sind unterschiedlich und reichen von Bruchteilen von Sekunden bis zu mehreren Milliarden Jahren.
Radionuklid Halbwertszeit Polonium-214 160 Mikrosekunden Wismut-214 19,9 Minuten Radon-222 3,8 Tage Blei-210 22 Jahre Radium-226 1600 Jahre Kohlenstoff-14 5370 Jahre Uran-235 700 Millionen Jahre Kalium-40 1,3 Milliarden Jahre Uran-238 4,5 Milliarden Jahre
Übung
Vervollständige folgenden Lückentext zum Thema „Radioaktivität“:
Unter Radioaktivität versteht man den - (1) - instabiler Isotope in für diese charakteristischen Zeiten, den sogenannten - (2) - .
Die Art der emittierten Strahlung bestimmt bei diesem Zerfallsvorgang die Folgeprodukte:
- Ein Alpha-Strahler emittiert Heliumkerne, somit vermindert sich für das Folgeprodukt die Massenzahl um den Wert - (3) -, die Ordnungszahl um - (4) -.
- Beta-Strahlung hingegen besteht aus - (5) - , die durch Spaltung eines instabilen - (6) -entstehen. Damit kann für das Isotop des Folgeproduktes sowohl die Massen- als auch die Ordnungszahl errechnet werden.
Hierbei gilt: die - (7) - bleibt konstant, die - (8) - erhöht sich um den Wert - (9) -.
So zerfällt der radioaktive Beta-Strahler Kohlenstoff C-14 in das stabile Isotop - (10) - des Elementes - (11) -.
| Im Chemiebuch ... | ||
|---|---|---|
| findest Du weitere Informationen zum Thema Radioaktivität: | ||
Chemie FOS-T
auf Seite |
Chemie heute
auf Seite |
Elemente Chemie
auf Seite |