Aminosäuren: Unterschied zwischen den Versionen
Imke (Diskussion | Beiträge) |
Imke (Diskussion | Beiträge) (→Wissenschaftlicher Nutzen) |
||
| Zeile 95: | Zeile 95: | ||
Kriminalbiologie, DNA Überführung von Kriminellen | Kriminalbiologie, DNA Überführung von Kriminellen | ||
Vaterschaftstest | Vaterschaftstest | ||
| + | DNA diagnostik [[Bild:Pfeil.gif]]Hilfsmittel zur Untersuchung von genetischen und Infektionskrankheiten (römpp) | ||
| + | |||
| + | DNA-Fingerprint-Analyse | ||
== Quellen == | == Quellen == | ||
Version vom 28. September 2006, 10:02 Uhr
 |
Dieser Artikel ist unvollständig und wird zur Zeit bearbeitet. |
Inhaltsverzeichnis
Allgemein
Aminosäuren auch: Aminocarbonsäuren sind organische Verbindungen, die als funktionelle Gruppen sowohl eine Carboxyl- (-COOH) als auch eine Aminogruppe enthalten. Sie sind die kleinsten Bausteine der Proteine und obwohl es nur 20 verschiedene Aminosäuren gibt, lassen sie sich auf viele verschiedene Weisen zu unterschiedlichen Proteinen kombinieren. Zum Vergleich eignet sich hier das Alphabet besonders gut. Es besteht nur aus 24 Buchstaben und doch lassen sie sich zu Wörtern, Sätzen und Büchern zusammensetzen.
Funktionen
Biochemische Funktionen
Die Aminosäuren dienen dem Aufbau von Peptiden (z.B. DNA), aus denen die Proteine aufgebaut werden können. Aus ihnen besteht nicht nur die Muskulatur und die Zellwände, sondern auch anderelebenswichtigen Verbindungen, wie z.B. Hormone, Enzyme und die Antikörper des Immunsystems. In der Neurochemie spielen Aminosäuren und ihre Derivate eine wichtige Rolle als Neurotransmitter. Insgesamt finden sich im menschlichen Organismus ca. 50.000 verschiedene Proteine, die alle unterschiedliche Aufgaben übernehmen. (?)
(Pufferfunktionen ganz wichtig!! zwei große Funktionesbereiche: Aufbau der Proteine und Pufferfunktion)
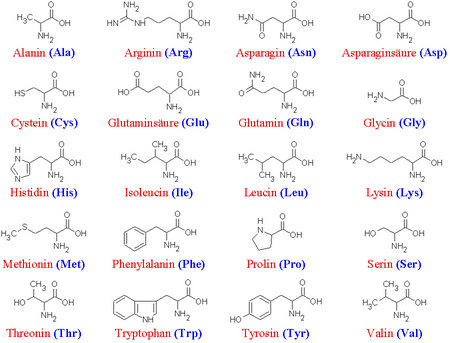
Chemischer Aufbau
| L-Alanin | (Ala) | |
| L-Aspartat | (Asp) | |
| L-Asparagin | (Asn) | |
| L-Cystein | (Cys) | |
| L-Glutamin | (Gln) | |
| Glycin | (Gly) | |
| L-Histidin | (His) | |
| L-Isoleucin | (Ile) | essentiell |
| L-Leucin | (Leu) | essentiell |
| L-Lysin | (Lys) | essentiell |
| L-Methionin | (Met) | essentiell |
| L-Phenylalanin | (Phe) | essentiell |
| L-Prolin | (Pro) | |
| L-Serin | (Ser) | |
| L-Threonin | (Thr) | essentiell |
| L-Tryptophan | (Trp) | essentiell |
| L-Tyrosin | (Tyr) | |
| L-Valin | (Val) | essentiell |
Aminosäuren sind Carbonsäuren, die zusätzlich zur Carboxylgruppe eine weiter funktionelle Aminogruppe am alpha-C-Atom enthalten. Die einfachste von ihnen ist das Glycin. Um weitere Aminosäuren aufzubauen wird das Wasserstoffatom am alpha-C-Atom durch eine Seitenkette (-R) ersetzt. Diese Seitenkette bestimmt die chemischen und physikalischen Eigenschaften des Moleküls, sodass sich folgende Gruppen einteilen lassen:
Neutrale Aminosäuren
Polar: (hydrophil) Seitenkette enthält eine Hydroxyl- oder Sulfhydrylgruppe z.B. Serin
Unpolar: (hydrophob) Seitenkette enthält Kohlenwasserstoffreste z.B. Alanin
Saure Aminosäuren
Enthalten zusätzlich eine Aminogruppe z.B. Lysin
Basische Aminosäuren
Enthalten zusätzlich eine Carboxylgruppe z.B. Aspartat
Säure- Basen- Eigenschaften
Ein ungeladener Zustand, wie er oft in Strukturformeln dargestellt wird, existiert praktisch nicht. Aminosäuren sind Zwitterionen d.h. sie reagieren sowohl sauer (Protonendonatoren) als auch basisch (Protonenakzeptoren), auch Ampholyte genannt. Dadurch haben sie im Organismus eine Pufferfunktion, indem sie den pH-Wert reagulieren. (Sie sind nach außen hin ungeladen, weisen aber NH3+ und COO- auf)
Erniedrigung des pH-Wertes: Proton wird an die COO- Gruppe abgegeben ![]() Zwitterion wird zum positiven Kation.
Zwitterion wird zum positiven Kation.
Erhöhung des pH-Wetes: Abgabe eines Protons an die NH3-Gruppe ![]() Zwitterion wird zum neagtiven Anion
Zwitterion wird zum neagtiven Anion
Essentielle Aminosäuren
Essentielle Aminosäuren können vom Körper nicht selbst synthetisiert, sondern müssen mit der Nahrung aufgenommen werden. Für den Menschen sind dies Isoleucin, Leucin, Lysin, Metheonin, Phenylalanin, Threonin, Tryptophan und Valin. Daneben werden einige Aminosäuren als semi-essentiell bezeichnet, da diese nur in bestimmten Situationen bzw. bei erhöhtem Bedarf oder Mangelerscheinungen gezielt mit der Nahrung aufgenommen werden müssen z.B. Wachstum, Verletzungen. Als semi-essentiell gelten Histidin, Arginin, Tyrosin und Cystein.
Die letzten beiden nehmen eine Sonderstellung ein, da sie aus den essentiellen Aminosäuren Metheonin und Phenylalanin sythetisiert werden können.
Einne mangelhafte Aufnahme von essentiellen Aminosäuren führt zu einem Stocken der Eiweißsynthese und somit gegebenenfalls zu lebensbedrohlichen Mangelerscheinungen.
Wissenschaftlicher Nutzen
Kriminalbiologie, DNA Überführung von Kriminellen
Vaterschaftstest
DNA diagnostik ![]() Hilfsmittel zur Untersuchung von genetischen und Infektionskrankheiten (römpp)
Hilfsmittel zur Untersuchung von genetischen und Infektionskrankheiten (römpp)
DNA-Fingerprint-Analyse
Quellen
Chemie heute Sek. II, Schroedel Verlag, 1998, S. 372 ff
Grundfragen der Ernährung, Verlag Handwerk und Technik, S. 101 ff
Chemie heute Sek II, Schroedel Verlag, 1992, S. 378 ff
Römpp Chemielexikon, Thieme Verlag, 9. Auflage, S. 160 ff
19.7