Galvanische Zelle
Inhaltsverzeichnis
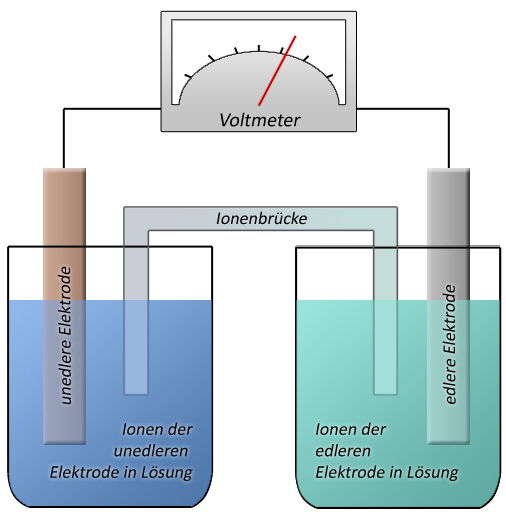
Bild einer Galvanischen Zelle
Galvanische Zelle
Eine galvanische Zelle oder galvanisches Element ist eine Vorrichtung zur Umwandlung von chemischer in elektrische Energie. Sie wird in Batterien und Akkumulatoren verwendet. Die Funktion der galvanischen Zelle beruht auf einer Redox-Reaktion. Die Reduktion läuft räumlich getrennt von der Oxidation in je einer Halbzelle (Halbelement) ab. Durch Verbinden der beiden Halbzellen mit einem Elektronenleiter und einem Ionenleiter wird der Stromkreis geschlossen. Der Name geht auf den italienischen Arzt Luigi Galvani zurück. Beispiel: Kupferelektrode in Kupfersulfat-Lösung und Zinkelektrode in Zinksulfatlösung, verbunden durch einen Draht (Elektronenleiter) mit Voltmeter und einen Ionenleiter. An der negativen Elektrode, hier die Zinkanode, gehen mehr Zn2+-Ionen in Lösung als sich Zn Ionen wieder abscheiden. Da das Zinn Elektronen an die Elektrode abgibt wenn es in Lösung geht lädt sich die Elektrode negativ auf. An der Kupferkathode scheiden sich dagegen mehr Cu2+-Ionen an der Elektrode ab als in Lösung gehen. da die Cu2+-Ionen zum Abscheiden zwei Elektronen verbrauchen gibt es an der Kupferelektrode Elektronenmangel, sie lädt sich positiv auf.
Wenn nun der positive Pol und der negative Pol elektrisch leitend verbunden werden, dann fließen Elektronen (ein elektrischer Strom, physikalische Stromrichtung) von der negativen Elektrode zur positiven Elektrode. Zwischen den beiden Elektrolyten findet der Ladungstransport durch Ionen statt.
In der Zinksulfatlösung entsteht allerdings ein Überschuss an Zn2+-Ionen und die Lösung lädt sich stark positiv auf, sodass nur noch so viele Zinkionen in Lösung gehen wie sich gleichzeitig an der Elektrode wieder abscheiden. Ähnliches passiert mit der Kupfersulfatlösung, nur dass sich hier die Lösung negativ aufläd. Kupfersulfatlösung: c[SO42-] >> c[Cu2+]Zinksulfatlösung: c[SO42-] << c[Zn2+]Deswegen werden die Lösungen mit einer Ionenbrückeverbunden. So können die SO42--Ionen aus der Kupfer- in die Zinklösung wandern und die Zn2+-Ionen aus der Zink- in die Kupfersulfatlösung. Es findet ein Ladungsausgleich zwischen den zwei Lösungen statt und der Strom kann fließen.
Redoxpotentiale
Diese Tabelle zeigt die Redoxpotentiale der wichtigsten Metalle sowie von Wasserstoff und Fluor. 
Definition Redoxpotentiale
Redoxpotential = ein Maß für die Fähigkeit eines Stoffes, Elektronen abzugeben. Hohes (negatives) Redoxpotential: der Stoff gibt gerne Elektonen ab. Niedriges (positives) Redoxpotential: der Stoff gibt Elektronen gar nicht gerne ab, im Gegenteil, er nimmt lieber Elektronen auf
Weitere Seiten
--Franzi g 08:16, 14. Jan 2008 (CET)